Que Son Niveles Energéticos
En química y teoría
atómica se parte del hecho de que los electrones que forman
parte del átomo están distribuidos en "capas" o niveles energéticos.
En función de la capa que ocupe un electrón tiene una u otra energía de ahí que
se diga que ocupa una capa de cierto nivel energético. La existencia de capas
se debe a dos hechos: el principio de exclusión de Pauli que
limita el número de electrones por capa, y el hecho de que sólo ciertos valores
de la energía están permitidos (técnicamente estos valores coinciden con los auto valores del
operador hamiltoniano cuántico que describe la dinámica de los electrones que
interaccionan electromagnéticamente con el núcleo atómico).
Si bien un electrón no puede adoptar cualquier
tipo de energía sino sólo unas determinadas asociadas a los niveles energéticos
de cada átomo, si es posible si se aporta energía a los electrones que estos
"salten" a otros niveles de energía superiores, pasando el átomo a
estar en un estado excitado. La electrodinámica cuántica implica que
estos estados excitados del átomo, donde un electrón ocupa un nivel energético
alto existiendo huecos en los niveles inferiores son inestables, por lo que al
cabo de unos instantes el electrón "decae" a niveles más bajos y
emite la energía sobrante en forma de fotones.
Más técnicamente en mecánica cuántica las capas
se modelizan como orbitales
atómicos que son distribuciones de carga eléctrica en el
espacio, cuya forma exacta depende de los detalles del modelo atómico de Schrödinger que
está formado por soluciones exactas de la llamada ecuación de Schrödinger. En el modelo de
Schrödinger y otros anteriores la estructura de capas electrónicas u orbitales
es lo que explica la reactividad del átomo y los tipos de combinaciones
(compuestos) que éste átomo puede formar. En ciertas situaciones físicas el
modelo atómico de Schrödinger es inexacto y por ejemplo no puede explicar la
estructura final del espectro, en esos casos frecuentemente se requiere la
consideración del espín electrónico y el uso de la ecuación relativista de Dirac. Aunque la mayor
parte de las aplicaciones a la química pueden ser descritas mediante el modelo
de Schrödinger que es algo más simple.
Un orbital
atómico viene representado por una función matemática que
describe la distribución de probabilidad de uno o dos electrones en un átomo,
dicha función es una función propia del hamiltoniano del átomo hidrogenoide. Un orbital molecular es
análogo, pero para moléculas.
Que Son Subniveles
energéticos
Bohr suponía
que todos los electrones de una misma órbita o nivel tenían igual cantidad de energía, pero estudios
posteriores indicaron que a excepción del 1º nivel (1 o K), los demás están
formados por VARIOS SUBNIVELES AGRUPADOS entre si.
Por
ejemplo la órbita K o 1 donde n=1, tiene un solo nivel con 2 electrones.
La
órbita L o 2 donde n=2, hay
dos subniveles, donde se ubican los 8 electrones. Los subniveles S y p.
La
órbita M o 3 donde n=3, hay tres subniveles para ubicar los 18 electrones. Los
subniveles S, p y d.-
El
nivel 4 o N donde n=4, hay
14 electrones que se ubican en 4 subniveles: S, p, d y f.-
Entonces, según la regla de hund. El orden en el que se van complementando los
subniveles de energía creciente es:
1 s, 2
s , 2 p , 3 s , 3 p, 4 s, 3d, 4 p, 5 s, 4 d , 5 p , 4 f, 5 d, 6 p, 7 s , 5 f, 6d, 7 p.-
ORBITAL ATÓMICO:
Dado que es imposible determinar con
exactitud la trayectoria del electrón dentro del átomo, se hable de probabilidad de
encontrar un electrón en Una zona de átomo.
En con secuencia se puede imaginar el núcleo positivo del
átomo rodeado por una nube de carga eléctrica negativa, provocada por los
electrones en movimiento. Es conveniente aclarar que en la actualidad no se
considera al electrón como una partícula sino como una onda o nube negativa de
carga negativa que ocupa un estado alrededor del núcleo.
Por eso definimos:
Orbital
atómico: es la zona alrededor del núcleo donde existe la mayor probabilidad de
encontrar al electrón. -
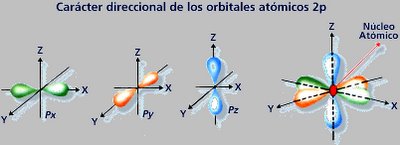
Forma de los orbitales de los
Subniveles: El subnivel S es redondo y el P se
presenta elíptico en las tres dimensiones: x,
y, z.
SPIN del
electrón: es la facultad que tiene un electrón de girar
sobre si mismo en una misma dirección y dos sentidos posibles.
REPRESENTACIÓN DE LOS ELECTRONES EN ORBITALES
Para
visualizar los electrones en orbitales, se puede representar cada orbital con
un cuadrado dividido
por una diagonal, y a cada electrón con una flecha: De esta forma el
orbital puede estar:
Vacio Incompleto Completo
(Sin
electrones) (Con un solo electrón) (Con los dos electrones)
Las flechas tienen que tener sentidos
distintos para indicar que los electrones tienen SPIN CONTRARIO.-
EL
LLENADO DE ORBITALES POR LOS ELECTRONES SE REALIZA A PARTIR DE LOS NIVELES Y
SUBNIVELES POR ORDEN CRECIENTE DE ENERGÍA (Hacer el llenado según la REGLA
DE HUND)
No se completa un orbital hasta que haya un electrón
en todos los orbitales de su subnivel.
Nombre Relación con
la configuración
electrónica
Niveles se relacionan
en que dependiendo del
número de niveles que tenga
un átomo se realiza la
Configuración electrónica.
Subniveles Se relacionan ya que para completar
la
Tabla de configuración electrónica se
necesita Saber de cuantos subniveles
están agrupados
entre sí.
Orbitales Se relaciona
ya que necesita saber
cuantos orbitales tiene para así
completar toda
la configuración
electrónica necesaria
ya que se
necesita saber el numero de
electrones en los subniveles.
Conclusión:
Para elaborar una tabla de configuración electrónica se
necesita todas y cada uno de estos nombres (nivel subnivel orbitales), ya que
para saber cuantos electrones existen en los subniveles se necesita saber cuantos
átomos hay en los niveles, y para saber cuantos orbitales hay en un electrón se
necesita saber cuantos subniveles existen.
Relación entre
la tabla periódica y la configuración Electrónica
Al referirnos a
la configuración electrónica (o periódica) estamos
hablando de la descripción de la ubicación de los electrones en los distintos
niveles (con subniveles y orbitales) de un determinado átomo.
Científicamente, diremos que es la representación del modelo atómico de Schrödinger o modelo de la mecánica cuántica. En esta representación se indican los niveles, subniveles y los orbitales que ocupan los electrones.Configurar significa "ordenar" o "acomodar", y electrónico deriva de "electrón"; así, configuración electrónica es la manera ordenada de repartir los electrones en los niveles y subniveles de energía.
Debemos acotar
que aunque el modelo de Schrödinger es exacto sólo para el átomo de hidrógeno,
para otros átomos es aplicable el mismo modelo mediante aproximaciones muy
buenas.
Para comprender
(visualizar o graficar) el mapa de configuración electrónica (o
periódica) es necesario revisar los siguientes conceptos.







Espectacular!!!
ResponderEliminarMaking Money - Work/Tennis: The Ultimate Guide
ResponderEliminarThe way you would expect febcasino.com from betting on the tennis matches of tennis gri-go.com is to bet on the wooricasinos.info player you like most. หาเงินออนไลน์ But you also need a different